

生物制品通常以微生物或人/动物源的细胞、组织和体液等为原材料,这些原料、辅料潜在的病毒污染是影响生物制品安全性的关键因素。生物制品的病毒安全性评价,是其审评上市的重要一环。
但一直以来,国内除病毒验证方案,都是遵循CDE(国家药品监督管理局药品审评中心)2005年颁布的《生物组织提取制品和真核细胞表达制品的病毒安全性评价技术审评一般原则》。该原则与ICH的国际标准,在验证批次和模型病毒选择上都有不同的要求。
因此,无论是IND(Investigational New Drug)还是BLA(Biologic License Application)阶段的除病毒验证,为迎合国内和国外法规的要求,都是需要准备两套方案的。
中国也一直在努力加速与国际标准接轨,几年前就开始逐步扩大与ICH接轨的范围。今年5月为了抗击疫情,CDE更是提前践行ICH指导原则,颁布了《新型冠状病毒中和抗体类药物技术资料要求(药学)(征求意见稿)》。切切实实加速了抗病毒药物的研发!
针对生物制品的病毒安全控制,2020新药典首次给出了权威的指导原则,新增了《生物制品病毒安全性控制》章节。对于生物制药行业,这绝对是喜大普奔的好消息!至此,中国药典不仅仅持平国际标准,更在一定程度上超越了目前的国际水平,开始引领法规沿革的大趋势。
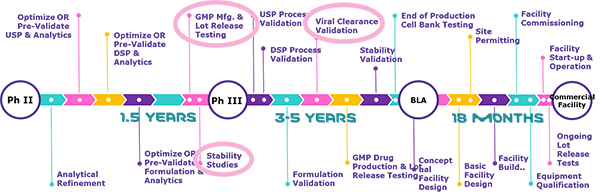
2020年10月14日,默克BioReliance®测试服务部门PSS高级技术经理 高飞博士 将带来:“生物大分子药物临床三期及商业化生产质量检测策略(Testing Strategy for Biologic Therapies Approaching Phase III and Commercialization)”的解读。将结合2020版中国药典和ICH-Q2,介绍法规中对于上市申报的最新规定以及BLA申报阶段的生物安全检测方案。
版权所有 ©深圳荣格广告有限公司 ©2025。